Mejoramiento y desmejoramiento animal,
o la deseada tecnificación de los animales
Hace ya más de dos décadas que el catedrático de historia del MIT, Bruce Mazlish, en su famoso libro sobre el desarrollo tecnológico y el futuro de la humanidad, titulado La cuarta discontinuidad. La coevolución de hombres y máquinas, escribió lo siguiente:
A la larga, las nuevas creaciones mecánicas [de la era industrial] no sólo desplazaron a los hombres sino también a los animales (¿animales-máquinas?). Podemos decir que lo que sucedió fue, sobre todo para muchos animales, una forma de emancipación. Dejaron de hacer falta perros para cazar, caballos para arrastrar y ser cabalgados, bueyes para arar. Pero, por ironía del destino, esta nueva «libertad» traía consigo la posibilidad de que fueran eliminados, o al menos que en cierto modo cayeran en desuso; con suerte algunos de estos animales iban a sobrevivir como mascotas o a ser utilizados en los deportes, no en actividades productivas. (Mazlish 1995, p. 107).
Hoy sabemos que la apreciación de Mazlish en este punto estaba bastante equivocada. Es cierto que muchos animales utilizados profusamente en la vida agrícola, como los asnos, perdieron su función y han estado a punto de desaparecer en muchos lugares, pero los animales han seguido ocupando un puesto central como herramientas para el ser humano, aunque ahora como herramientas más sofisticadas y para fines mucho más diversos que la ayuda en el trabajo físico. En realidad, su uso en “actividades productivas” no ha hecho sino crecer. El avance de la biotecnología los ha recuperado para explotarlos de formas más exhaustivas que las propias de la economía tradicional. En los países más desarrollados ya no ayudan en la labranza de los campos, ni en el transporte, ni potencian nuestras capacidades, como hizo el caballo durante siglos para llevarnos a lugares remotos. Para eso ya están las máquinas, que lo hacen de modos mucho más eficientes.
En cambio, los animales se han convertido ahora en una fuente muy valiosa de recursos alimenticios y biomédicos, sometidos al control constante de tecnologías complejas. Se calcula que el número actual de animales de granja (vertebrados) en estocaje en un momento dado es de unos 25 mil millones, de los cuales 19 mil millones son pollos. A estos habría que añadir 100 millones de vertebrados mantenidos en los laboratorios de todo el mundo. Cada año se sacrifican para alimentación 50 mil millones de pollos y mil quinientos millones de cerdos. Todos ellos serían animales bajo el control directo de los seres humanos para obtener algún beneficio
§1. Algunas realidades

El desarrollo de las técnicas de clonación, de transgénesis (ya sea mediante inserción de genes o mediante su desactivación (knock out)), ha propiciado que la bioingeniería se aplique con éxito a un buen número de organismos. Como consecuencia de ello, el debate sobre las plantas y animales transgénicos se ha vuelto ya una constante cultural, pero no siempre parece estar claro para los intervinientes que en este debate son importantes los matices, que el alcance y las implicaciones de una técnica no siempre son extrapolables, y que la aceptación social también puede variar de forma decisiva en unos casos y en otros.
La clonación, en la versión más practicada en ganadería, que es la gemelación artificial o división de embriones, parece a estas alturas algo establecido y asumido de forma general. Consiste en crear embriones que sean copias genéticas unos de otros a partir de la separación de las células blastómeras. Esta técnica de clonación se limita a producir gemelos a partir de un embrión y es muy diferente de la que se usó en la clonación de la oveja Dolly (y después en otros animales), conocida como clonación por trasferencia nuclear, cuyas consecuencias sobre el organismo han sido muy criticadas.
En las ganaderías de muchos países es común recurrir a esta técnica de división de embriones para perpetuar las buenas cualidades de los mejores sementales o de las hembras más productivas. Se ha conseguido de este modo aumentar la producción de leche y de carne, y el consumo de los productos de animales así manipulados está legalizado en muchos países.
En cuanto a la creación de animales transgénicos, las técnicas usadas han experimentado un enorme desarrollo desde el primer caso documentado, el de un ratón creado en 1974 por Rudolf Jaenisch. Desde principios de los 80 tenemos en los laboratorios de medio mundo un muestrario sumamente variado de ratones transgénicos para ser utilizados como modelos en la investigación biomédica, a los que se han ido sumando con posterioridad cerdos, conejos, ovejas y otros animales expresamente diseñados en el laboratorio para desarrollar una cierta enfermedad (en especial algún tipo de cáncer, diabetes, deficiencia cardiovascular, regulación defectuosa del colesterol, o de la cortisona), o bien simplemente para presentar una determinada característica fisiológica, anatómica, funcional o morfológica de interés para la investigación.
Hay, asimismo, animales transgénicos que son más resistentes a las enfermedades, tienen mayor masa muscular o presentan un metabolismo modificado. Gracias a la técnica CRISPR-Cas9 de edición genética se han conseguido otros animales genéticamente modificados con resultados sorprendentes y, en ocasiones, insertando alelos que se dan de forma natural dentro de la misma especie, con lo cual es muy discutible que puedan ser designados como transgénicos. Se han conseguido así vacas sin cuernos, ovejas que aúnan buena carne y buena lana, o cerdos cuyas células llevan inactivados todos los retrovirus que, en caso de que alguna vez sean utilizados para xenotransplantes, no infectarían al ser humano (cf. Montoliu 2019).
-
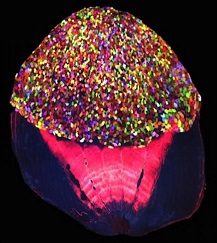
¿Mejoramiento animal? Este pez cebra transgénico puede emitir aleatoriamente unas 5000 tonalidades cromáticas (Infografía)
Además de estos usos orientados fundamentalmente a la investigación, hay otros que se han puesto en práctica y manifiestan una asombrosa efectividad, en especial los usos biomédicos de estas técnicas. Comenzando en el año 2015, han sido ya liberados en Brasil más de 25 millones de mosquitos transgénicos para luchar contra la propagación del dengue y del zika. Los machos son manipulados genéticamente para producir una proteína que es letal para la descendencia. No era la primera vez que se utilizaban animales transgénicos para luchar contra una plaga, pero sí ha sido la vez que más atención ha recibido por los medios de comunicación de todo el mundo.
Por otro lado, desde hace unos pocos años se vienen modificando genéticamente diversos animales, introduciéndoles algún gen humano o de otra especie distinta, para que produzcan proteínas, hormonas, anticuerpos, o cualquier otra sustancia orgánica de interés médico o industrial. Los casos más conocidos son el de las vacas que incorporan en su leche la hormona humana del crecimiento, el de las cabras que producen la proteína humana antitrombina, que es anticoagulante y se utiliza en la prevención y tratamiento de tromboembolias, el las vacas y cabras que producen una leche parecida a la humana en sus proteínas, el de los cerdos que generan ácidos grasos omega-3, el de las vacas que producen insulina, el de las gallinas cuyos huevos contienen interferón-β, y el de las cabras con genes de araña que producen proteínas de la seda en su leche.
Fue muy sonado en su momento el conejo transgénico que incorporaba un gen de medusa (el gen que codifica la proteína GFP) que le hacía brillar de forma fluorescente cuando era iluminado con luz azul. Está a la venta en los Estados Unidos un pez cebra transgénico, GloFish, que porta el mismo gen y es también fluorescente. Los hay ya de varios colores. (Véase Anthes (2013) para la descripción de algunos de estos casos). En cuanto a la comercialización de carne de animales transgénicos, por el momento, el único animal transgénico cuyo consumo ha sido permitido en los Estados Unidos es el salmón gigante AquAdvantage, que recibió la aprobación de la FDA (Food and Drug Administration) en 2015, pero el camino ya está trazado.
§2. Imaginando (un poco) el futuro
Lo que acabamos de presentar son solo algunos de los resultados más notables conseguidos hasta el momento en la aplicación de las biotecnologías a los animales, pero ¿qué nos depara el futuro? Todos los analistas, tanto los críticos como los partidarios entusiastas, reconocen que las posibilidades que se abren son asombrosas y que podrían cambiar radicalmente la vida en nuestro planeta.
Si los defensores del transhumanismo anuncian que estamos cada vez más cerca de hacer factible el control y dirección de la evolución humana a través de la tecnología, otro tanto podría decirse de la evolución de los animales y de las plantas, sobre todo de los que más interés tienen para los seres humanos.
Mediante la cría y la selección artificial, hace tiempo que los humanos tomamos las riendas de la evolución de esos animales y plantas, como bien explicó Darwin en el comienzo de El origen de las especies, pero, gracias a la ingeniería genética y a su sucesora la biología sintética, ese control se ha vuelto mucho más efectivo y rápido, y se dice que en el futuro podremos rediseñar especies casi a nuestro antojo. Este tipo de transformaciones es lo que se ha denominado ‘biomejoramiento animal’. Sarah Chan (2009 p. 679) ha proporcionado una interesante definición de este concepto:
Un mejoramiento de un animal puede ser algo que: (1) produzca un incremento en alguna función natural o confiera una nueva función; (2) mejore algún aspecto del animal para propósitos humanos; (3) permita al animal un cumplimiento mayor de sus propios intereses.
Es de resaltar que en esta definición se considera que un animal puede ser mejorado tanto si el resultado es beneficioso para los seres humanos (aunque no lo sea para el animal), como si lo es para el animal (aunque no lo sea para los seres humanos). Esto marca una asimetría importante con lo que suele entenderse por ‘biomejoramiento humano’, en el que solo los intereses de los individuos implicados se consideran relevantes.
Hasta ahora tenemos ejemplos de modificaciones en animales para satisfacer propósitos humanos, pero no de modificaciones que permitan a esos animales satisfacer mejor sus intereses, al menos de forma clara, aunque no es descartable que en el futuro puedan tenerse en cuenta esos intereses en los procesos de mejoramiento. De hecho, para algunos autores, un mejoramiento animal que no fuera en interés del propio animal, sino en beneficio exclusivo de nuestra especie, no sería un auténtico “mejoramiento” (cf. Burgat 2015).
Desde esta perspectiva, casi nada de lo realizado hasta ahora por los ganaderos y criadores para producir razas más beneficiosas desde el punto de vista comercial, o más agradables a la vista de los propietarios de mascotas, debe considerarse como mejoramiento animal. Al igual que tampoco podría ser considerado como mejoramiento animal lo realizado por los biotecnólogos en orden a generar animales para la investigación médica, o para la producción de sustancias útiles para el ser humano. Solo aquellas modificaciones que hayan ido en beneficio de la salud de los animales podrían contarse como tal, pero lo cierto es que los casos en los que se ha reforzado su resistencia a las enfermedades han sido en animales domésticos y el objetivo final no era el bienestar del animal propiamente dicho, sino la satisfacción de intereses comerciales.
Si las aplicaciones más conocidas de la ingeniería genética a los animales han generado ya una intensa discusión ética y filosófica, mucho más controvertidas serán sin duda las posibles transformaciones que se supone que pondrá a nuestro alcance el futuro desarrollo de la biotecnología. Mencionemos algunas de ellas que, siendo especulativas, están fundamentadas en lo que permite inferir el perfeccionamiento factible y el uso extendido de técnicas que ya están en ejercicio.
1. Ruptura definitiva de la barrera genética entre especies, y muy particularmente la barrera entre el ser humano y otros animales [1]
Ya hemos mencionado que en la actualidad existen animales que llevan incorporado en algunas de sus células un gen humano que les faculta para producir sustancias o medicamentos aprovechables por la industria farmacéutica, o que, como en el caso de los onco-ratones, hacen que desarrollen ciertas enfermedades, de modo que éstas pueden ser estudiadas con técnicas que no son practicables en humanos por razones éticas. En un cierto sentido del término, la mayoría son quimeras, puesto que en algunas de sus células la dotación genética proviene de dos organismos distintos, pertenecientes en este caso a especies diferentes.[2]
Ahora bien, dado que son uno o pocos los genes humanos que portan y conservan la misma apariencia que los animales de su misma especie, su creación no ha generado demasiada polémica. Excepto para algunos grupos religiosos, para animalistas radicales que desean acabar con cualquier tipo de experimentación en animales, o para quienes consideran intrínsecamente censurable por anti-natural la mezcla de especies (desconociendo quizás que la hibridación ha sido una constante a lo largo de la evolución de la vida en este planeta), este tipo de quimeras no han sido juzgadas como un desafío significativo a principios éticos establecidos.
Sin embargo, las técnicas de ingeniería genética podrían ser utilizadas para la creación de animales con un mayor contenido genético humano del incorporado hasta ahora (no se olvide, no obstante, que los seres humanos ya comparten una buena parte de su genoma con todos los animales, alcanzándose en el caso de los chimpancés la cifra cercana a un 99% de genes compartidos). Se está investigando desde hace unos años en la creación de ovejas y cerdos transgénicos en los que la inserción de genes humanos o de células madre humanas haría que estos desarrollasen órganos o tejidos que no fueran rechazados por nuestro sistema inmunológico, lo que abriría las puertas a los xenotrasplantes.

-
En 2017 saltó a la prensa la noticia de que un equipo dirigido por Juan Carlos Izpisúa consiguió desarrollar hasta los 28 días embriones de cerdos con células humanas, con resultados poco efectivos. No era, ciertamente, la primera vez que se generaban quimeras de animal y humano, aunque fuera con técnicas menos sofisticadas, de modo que el revuelo causado parecía inexplicable, si no fuera porque muchos de los casos previos también causaron revuelo en su momento.
Pero la memoria, como es bien sabido, tiende a flaquear. A finales del pasado siglo comenzaron a crearse este tipo de quimeras mediante el trasplante de células humanas a diversos órganos de animales, incluyendo su cerebro. Citaremos algunos de los casos más significativos. En 1998 células madre neuronales humanas fueron trasplantadas a cerebros ratones recién nacidos. En 2001 se hizo algo similar pero esta vez se trasplantaron a cerebros de fetos de monos y se dejó que se desarrollaran hasta la décimo séptima semana de gestación.
Experimentos similares se realizaron en varias ocasiones durante los años siguientes. Desde 2001, con objeto de crear un modelo animal más apropiado para el estudio de la hepatitis y de otras enfermedades, se viene informando regularmente de la creación de ratones con células humanas (hepatocitos) integradas en su hígado, y en 2010 se consiguió con la misma técnica un ratón con hasta el 95% de hepatocitos humanos en su hígado, que le fueron trasplantados cuando tenía unos cuatro meses.
La técnica empleada por Izpisúa era más compleja y con mayor potencial: consistía en la inserción de células madres pluripotentes humanas en el embrión de un cerdo, de forma que las células crecían y se multiplicaban dentro del propio embrión animal. Esta técnica se había ensayado ya en 2006, en un trabajo en el que se consiguió integrar células madre embrionarias humanas en blastocitos de ratón. En febrero de 2018 un grupo de científicos de la Universidad de Stanford anunció que había conseguido desarrollar hasta los 28 días embriones de ovejas quiméricas con un 0.01% de células humanas.
Y como si todo se acelerara en los últimos tiempos, el 31 de julio de 2019 la prensa anunciaba, aunque esta vez sin el respaldo inmediato de una publicación científica, que Juan Carlos Izpisúa y su equipo habían logrado en un laboratorio en China (para soslayar las trabas legales en Estados Unidos o en Europa) crear quimeras aún más sorprendentes: de humano y mono. De nuevo, su desarrollo embrionario se interrumpió antes de nacer. Ese mismo día, nos enterábamos igualmente de que el gobierno de Japón había dado permiso al equipo dirigido por Hiromitsu Nakauchi para crear embriones animales con células humanas que puedan ser llevados a término, es decir, abriendo la puerta a que puedan nacer esos organismos.
A finales de los 70 del siglo XX se consiguió en fase embrionaria el primer “híbrido citoplasmático” de humano y animal, en concreto, de humano y ratón. Desde principios de este siglo se han creado varios de estos híbridos, fusionando células humanas con ranas, vacas, conejos y ratones. Los híbridos citoplasmáticos, también llamados «cíbridos», son organismos que surgen de la fertilización de un óvulo animal enucleado con un núcleo obtenido de una célula somática humana. Hasta el momento ninguno ha llegado a término. Todos han quedado en fase inicial de blastocito debido a las regulaciones legales existentes. En Gran Bretaña y en otros países europeos la ley prohíbe desarrollar estos híbridos más allá de los catorce días.
No podemos saber con seguridad cuál sería su viabilidad posterior. Quizás manifestaran grandes malformaciones que los hicieran inviables. No está claro cómo se desplegaría el programa epigenético de un organismo así, ni cómo interactuaría el ADN nuclear, que sería humano, con el ADN mitocondrial, que sería animal. Pero no puede descartarse la posibilidad futura del nacimiento de alguno de estos organismos.
Y cabe imaginar otras transformaciones más problemáticas desde un punto de vista ético. Podrían, por ejemplo, desarrollarse animales con cerebros constituidos por neuronas humanas o al menos con un alto porcentaje de ellas. De hecho, Irving Weissman, de la Universidad de Stanford, conocido por haber creado un ratón con un 1% de células humanas en su cerebro, solicitó permiso en 2005 para crear un ratón con un cerebro compuesto exclusivamente por neuronas humanas.[3] Hay que decir que este experimento nunca se realizó.
No obstante, en 2013 se publicó en la revista Cell Stem Cell un artículo que daba cuenta la creación de un ratón cuyo cerebro contenía una alta proporción de células gliales (astrocitos, en concreto) del cerebro humano, lo que potenció las capacidades cognitivas del mismo (Han et al. 2013; véase también Windrem et al. 2014). Esta sería una forma posible de lo que algunos denominan ‘Uplift’, esto es, el aumento de la inteligencia en animales a través de la tecnología.[4]
O, yendo por el camino inverso, en un futuro más lejano, podría pretenderse la creación de seres humanos con algunos genes animales incorporados a su genoma, o con células animales en determinadas partes de su cuerpo. El caso extremo –y el que con toda seguridad despertaría el mayor rechazo– sería el de organismos subhumanos por su combinación con animales, como describe la película Splice, de Vincenzo Natali.
Puede que hubiera quien llegara a defender que estos organismos fueran usados para la realización de trabajos desagradables o peligrosos, o para satisfacción sexual (como la citada película sugiere). Por el momento, y aunque esto es ciencia ficción, en previsión de mezclas así, en Estados Unidos y en otros países no está permitida la creación de híbridos o quimeras de humanos y chimpancés (ya tienen nombre previsto: «humancés»), pero si algún día se permite, esto abriría la puerta a posibilidades sumamente inquietantes.
Sin embargo, pese a que estas posibilidades tecnológicas no están tan lejanas[5] y pese a que la reacción instintiva de la mayoría de las personas es de fuerte oposición a que se materialicen alguna vez las más radicales, como los casos de híbridos o quimeras cuasi humanos, la reflexión ética y sociopolítica sobre este asunto está todavía en sus comienzos. Casi puede decirse que la discusión explícita comenzó con el caso que acabamos de citar del ratón con neuronas humanas en su cerebro.
No deja de sorprender que en uno de los análisis pioneros, el realizado por Jason Scott Robert and Françoise Baylis (Robert y Baylis 2003), el principal problema que se señale sea el de la confusión moral que se generaría a la hora de tratar estos hipotéticos organismos, es decir, el no saber qué estatus moral habría que concederles y cómo debería ser nuestro comportamiento hacia ellos; no saber, por ejemplo si deberían compartir con el ser humano su dignidad como personas.[6]
2. Producción de animales de diseño
Desde los orígenes mismos de la domesticación de animales a comienzos del neolítico, los seres humanos los han ido transformando según sus deseos y necesidades. Este objetivo es también el que ha guiado la aplicación de las técnicas de ingeniería genética a los animales de granja, modificándolos de formas ahora más radicales, al introducir en ellos genes de otras especies. Se usan habitualmente estas técnicas para que el ganado produzca más leche o más carne, pero es claro que su potencial para el rediseño es mucho mayor. Un ejemplo interesante ha sido el caso del “Enviropig”, el cerdo ecológico, desarrollado por la Universidad de Guelph para que sus deposiciones sean menos contaminantes en fósforo. El proyecto quedó aparcado en 2012 por falta de financiación y los cerdos fueron sacrificados.
Aquí, de nuevo, la imaginación puede dispararse. No es descabellado, por ejemplo, pensar en modificar animales de granja para que consuman menos alimentos, generando así menos gastos a sus propietarios, o para que produzcan una carne más sabrosa. Puestos a ahorrar en alimentos, ¿por qué no crear animales que obtengan nutrientes mediante fotosíntesis, quizás incorporando cloroplastos a sus células? Algo así se ha pedido ya incluso para los seres humanos.[7]
Aunque el mercado urbano, consumista y ansioso de novedades sorprendentes, se decantaría probablemente por otros objetivos más ligados a lo lúdico, lo formal y lo estético, las mascotas por encargo, personalizadas a capricho del demandante, podrían convertirse en una fuente inagotable de negocio para criadores con habilidades de biohacker. Son imaginables pretensiones más o menos razonables y poco polémicas, como la de crear mascotas hipoalergénicas o más longevas[8] (el alargamiento de la vida no solo se reclamaría para las mascotas, también para sementales en ganadería); pero, una vez en camino, ¿por qué no pedir mascotas que sean más simpáticas, inteligentes y agradables, o que sean mezcla de varias especies animales y conserven sus cualidades más deseables; de gato y perro, por ejemplo, aunando la gracilidad de los primeros y la fidelidad e inteligencia de los segundos?
Habrá también –cabe suponer– una fuerte demanda para el mejoramiento de mascotas con fines competitivos. Esto podría ser para algunos una trampa equivalente al dopaje en el deporte. Una mascota biomejorada presentaría una ventaja sobre cualquier otro animal de la misma especie que se habría conseguido mediante una ayuda tecnológica, no por el esfuerzo selectivo de su criador. Pero al igual que hay quien reclama la legalización del dopaje en el deporte (cf. Savulescu 2012), no sería extraño que la competición de mascotas biomejoradas fuera considerada legal en el futuro e incluso que se convirtiera en un espectáculo exitoso.
3. Cíborgs animales

Las mascotas artificiales, mezcla de animales y máquinas, tienen también un previsible mercado potencial y no se puede descartar –si es que son finalmente viables– que terminaran incluso desplazando a las puramente biológicas. No porque estas fueran más escasas y caras, como en la célebre novela de Philip K. Dick ¿Sueñan los androides con ovejas eléctricas?, en la que se inspiró la película Blade Runner, sino porque las artificiales, capaces de desplegar facultades obnubiladoras por medio de gadget de alta tecnología, podrían gozar del favor del público.
Según los analistas más convencidos del enorme desarrollo que podría experimentar la Inteligencia Artificial en los próximos años, nuestras máquinas estarán más cerca de nosotros que los animales. Podremos hablar con ellas y recibir sus opiniones y consejos. Serán nuestras compañeras, y suplirán en casi todo lo esencial a una persona como medio para evitar la soledad. Supongamos que esta predicción sea acertada. Si los animales quieren conservar su lugar junto a nosotros, tendrán entonces que ser mejorados para estar a un nivel comparable. No bastará con que nuestro perro nos reciba al llegar a casa moviendo el rabo, tendrá que decirnos de viva voz lo mucho que nos quiere y lo que nos ha echado de menos toda la mañana. La comunicación con los animales (a ser posible mejorados también en su inteligencia) a través de mediadores tecnológicos sería una circunstancia apetecible para muchos.

En la actualidad ya se fabrican prótesis, aún en fase de desarrollo, que se anuncian como capaces de traducir al lenguaje humano los pensamientos de un perro. Se trata de un casco con electrodos, fabricado por la Nordic Society for Invention and Discovery bajo el nombre de ‘No more woof’, que capta de forma externa al cráneo las señales electromagnéticas emitidas por el cerebro y las vierte, por medio de un sofisticado programa y con ayuda de un altavoz, al inglés (pero están en preparación otros idiomas, incluido el español), traduciendo supuestamente lo que el perro piensa. Sospecho que hay que tomar la noticia con cierto escepticismo, pero este tipo de interfaces comunicativas animal/humano podrían estar en funcionamiento en unos años y nos permitirían entonces echar un vistazo en el interior de la mente de nuestras mascotas.[9] ¿Quién resistiría la tentación?

4. Recuperación de especies extintas
Hasta donde yo sé, el único intento de recuperar una especie extinta mediante clonación fue realizado en España por un equipo de científicos españoles, franceses y holandeses liderados por el doctor José Folch. El intento tuvo un éxito escaso, porque el animal murió a los pocos minutos de nacer.
La especie a resucitar fue la cabra pirenaica o bucardo (Capra pyrenaica pyrenaica), cuyo último ejemplar murió en el año 2000. Se conservaban células de la piel, que se obtuvieron en 1999, cuando ese último ejemplar, un hembra, estaba aún vivo. El material genético de estas células fue introducido en oocitos enucleados de cabra doméstica (Capra hircus), generándose en dos series más de 200 embriones clónicos. De estos embriones, 57 fueron implantados para su gestación en cabras montesas del pirineo (Capra pyrenaica hispánica), que son cercanas genéticamente al bucardo. Solo una gestación llegó a término, y el cabrito nació el día 30 de julio de 2003, pero como hemos dicho, murió a los pocos minutos debido a una malformación en sus pulmones. En 2014, un segundo intento de resucitar el bucardo quedó paralizado por falta de financiación.
Han sido además varias las voces que se han alzado, tanto en revistas científicas como en medios de comunicación, contra la prosecución de estos intentos. Los críticos esgrimen razones técnicas (nula variabilidad genética, no se conservan células de machos y las que se tienen son de una hembra con problemas de patologías congénitas debido a la endogamia), pero también razones éticas (¿es moralmente aceptable resucitar una especie extinta?, ¿tendría suficiente calidad de vida?, ¿cómo afectaría a las especies que ahora ocupan su nicho ecológico?).
La polémica suscitada no ha desanimado, sin embargo, a los más entusiastas. El catedrático de genética de la Universidad de Harvard, Georg Church, ha expresado ya en diversas publicaciones y entrevistas su deseo de resucitar un mamut, algo que, según nos dice, los mamuts “están casi pidiendo a gritos” (Church y Regis 2012, p. 137) y que además contribuiría a aumentar la biodiversidad (supongo que en buena medida porque habría que resucitar también una parte sustancial de su ecosistema). Ya ha conseguido en su laboratorio insertar genes de mamut en un cultivo de células de la piel de un elefante asiático.[10] Se habla también de volver a la existencia a la paloma migratoria, al lobo marsupial, o al Uro, el toro ancestral europeo.
5. Desmejoramiento (disenhancement)
En el denso y prolijo debate sobre el mejoramiento humano se ha dicho que este puede consistir en ocasiones en una disminución de las capacidades poseídas en lugar de en un aumento de ellas. En ciertos contextos, una disminución de la capacidad para empatizar (en un manirroto, por ejemplo), o de la capacidad de memoria (en un traumatizado), o de la capacidad para amar (a un maltratador) puede ir en beneficio del bienestar del individuo (Earp et al. 2014). De forma análoga, algunos autores han defendido la conveniencia de la disminución de las capacidades sensoriales y mentales (autoconsciencia) de los animales con el fin de poder estabularlos más cómodamente y de utilizarlos como fuente de recursos alimenticios o para la investigación biomédica, sin causarles tanto sufrimiento como el que ahora padecen. Esto es algo que no está muy lejos de lo factible.

Un ensayo inicial ha mostrado que gallinas que sufren una ceguera congénita, cuando se estabulan juntas, pueden encontrar con facilidad agua y comida, consumen menos alimento, a pesar de lo cual ponen más huevos, y pierden menos plumas en peleas que con frecuencia llevan incluso a la muerte del animal. Este ensayo ha animado a algunos a propugnar que se busque expresamente el nacimiento de gallinas con este defecto genético para lograr una mayor eficiencia económica en su consumo al tiempo que, supuestamente, se aumenta su bienestar (Sandøe et al. 1999).
Se especula asimismo con la creación futura de animales de granja con un cerebro disminuido en sus capacidades, suficiente solo para mantener las funciones básicas del organismo (respiración, digestión, movimiento, respuestas automáticas, etc.). Desde una perspectiva estrictamente consecuencialista, esta práctica podría ser vista como irreprochable e incluso deseable, puesto que iría en interés de los propios animales el que se disminuyera la cantidad total de sufrimiento que se les inflige (Rollin 1995).
Claro que otros autores no lo ven del mismo modo, y los hay que consideran que el desmejoramiento no sería ético en ningún caso, o solo en condiciones muy especiales, y que choca contra nuestras intuiciones morales (Thomson 2008). Algunos afirman que atentaría contra la “integridad del animal”, contra el “telos” del animal, o incluso contra la “dignidad del animal” (Ortiz 2004).[11] Estos reparos han sido a su vez contestados señalando que un animal sin consciencia carecería de estatus moral y no tendría ningún sentido, por tanto, plantearse siquiera velar por su “integridad”, su “telos” o su “dignidad”.
No podemos entrar aquí en este desazonador debate ético. Baste con apuntar que, aunque la eventualidad de que las aves y mamíferos destinados a nuestro consumo dispusieran de cuerpos (casi) sin mente, o carentes de sensaciones conscientes, como sucede con los invertebrados más simples (cnidarios, platelmintos, nematodos, moluscos y equinodermos), podría estimarse en cierto modo como un procedimiento efectivo para disminuir el sufrimiento total que los seres humanos causan a los animales, desde otra perspectiva sería más bien una forma sutil de dañarlos (puesto que se les impediría, por ejemplo, tener experiencias subjetivas positivas), y por ende estaríamos agravando con ello la reificación de los animales. Acercar los animales a las plantas quitándoles sensibilidad y consciencia no parece que pueda considerarse un beneficio para ellos, por mucho que esa falta de sensibilidad les evite sufrimientos (causados por los seres humanos), que en todo caso habría formas mejores de evitar.
No obstante, también aquí habría que establecer distinciones relevantes. No sería lo mismo hacérselo a un animal existente que crear animales con esas características. Lo primero parece, prima facie, menos aceptable que lo segundo. Puede argumentarse, en efecto, que la disminución de las potencialidades de un animal existente ha de ser vista como un daño de algún tipo a un ser vivo que podría haber tenido una vida más plena si no hubiera sido sometido a esa modificación y se le hubiera dejado vivir en un ambiente adecuado, mientras que la creación de un animal con capacidades mentales disminuidas solo debería despertar rechazo si su vida fuera tan mala que no mereciera ser vivida.
No hace falta decir que está lejos de haber un acuerdo sobre este asunto. No está nada claro que no haya nada censurable moralmente en traer a la vida un animal disminuido cuando podría haberse traído un animal en condiciones normales (cf. Streiffer y Basil 2011). Se aduce que si es inmoral hacerlo con un ser humano, debería serlo igualmente con un animal.
§3. Sobre fronteras naturales y deseos artificiales
Ahora que el transhumanismo ha comenzado a despertar el interés del público, sería quizás oportuno llamar la atención sobre las posibilidades y riesgos de lo que podría llamarse “transanimalismo” si no fuera por la impropiedad del término, puesto que a diferencia de la transformación radical de un ser humano, que podría dar lugar a un organismo transhumano, la transformación radical de un animal seguiría generando un animal, aunque de otro tipo.
Una buena razón para prestarle atención es que no están claros ni bien definidos los límites morales que marcan lo que hemos de considerar como aceptable y lo que no en lo que respecta a las modificaciones tecnológicas que se esperan realizar sobre el cuerpo y la mente de los animales no humanos. El desacuerdo es aún más amplio si cabe que el que se da con respecto al eventual uso de la biotecnología en la modificación del ser humano, y ello pese a que la reflexión que se ha realizado hasta el momento acerca del biomejoramiento animal es escasa si la comparamos con la que se ha publicado sobre el mejoramiento humano.
Mientras crece la preocupación de la sociedad por el bienestar de los animales, tanto domésticos como salvajes, e incluso hay cada vez más personas convencidas de la necesidad de establecer ciertos derechos que los protejan frente a los abusos cometidos contra ellos por los seres humanos (cf. DeGrazia 2002), los cambios que se avecinan son tan enormes, como acabamos de ver, que parecen dejar en poco todo lo que se ha pensado hasta ahora. Son necesarias, pues, reflexiones bien informadas a las que acudir en busca de orientación en este asunto, y se puede decir que disponemos ya de algunas muy dignas de consideración.[12]
Hay, sin embargo, un aspecto de esta discusión en el que, según creo, no se ha puesto suficiente énfasis, y es el que me gustaría desarrollar aquí brevemente. En algunas publicaciones relevantes ha sido puesto exitosamente en circulación el llamado ‘síndrome Frankenstein’ (cf. Rollin 1995, Anthes 2013): una biotecnología fuera de control trae a la realidad criaturas útiles para los seres humanos pero desagradables o peligrosas o de miserable calidad de vida, cuya autonomía como seres vivos podría hacer que finalmente escaparan de cualquier supervisión humana y terminaran volviéndose en contra de nuestra salud o bienestar, dando lugar, por ejemplo, a plagas, invasión de ecosistemas, pérdida de biodiversidad, etc. Esta denuncia tiene sentido y es importante estar sobre aviso.
No obstante, tal como se anuncian hoy las cosas que resultarían realizables si continúa el desarrollo tecnológico previsible, creo que debería preocuparnos más lo que, en contraposición, podríamos denominar ‘síndrome Galatea’, porque muy posiblemente represente una situación tanto o más probable que la descrita por el síndrome Frankenstein y quizás constituya el acicate principal para que se produzcan muchos de los cambios menos deseables de los previstos.
-

Pigmalión y Galatea. Obra de Robert Cutler Hinckley (Infografía)
Recordemos que Galatea era el nombre de la estatua de marfil creada por Pigmalión, el mítico escultor y rey de Chipre, de la que éste se enamora apasionadamente, y a la que Afrodita, apiadada por los ruegos de Pigmalión, dota de vida propia. Al igual que en el mito, las criaturas producto de la biotecnología podrían ser objeto de un intenso deseo más que de repugnancia, como Galatea lo fue para Pigmalión, y no sería descartable que hubiera hasta quienes quisieran fundirse con ellas en algún tipo de estrecha relación biológica o psicológica.
Si los que señalan la existencia de un síndrome Frankenstein intentan ante todo prevenir sobre los efectos perjudiciales que la transformación tecnológica de los seres vivos podría tener para los seres humanos, la percepción de un síndrome Galatea fijaría más bien su mirada en los efectos perniciosos que para los propios animales tendrían las transformaciones realizadas sobre ellos con el solo objetivo de servir o agradar a los seres humanos. Cualquiera que conozca el grado de instrumentalización que sufren hoy los animales (que obviamente no podrían prestar su consentimiento para estas transformaciones, excepto mostrando físicamente su incomodidad o su dolor), reconocerá sin duda que esta posibilidad reclama alguna atención.
Son muchos los que, desde diversas posiciones políticas y filosóficas, ponen reparos a la aplicación de la biotecnología para la transformación radical del ser humano, como la que pretende el sector más duro del transhumanismo, pero son menos las voces preocupadas por las consecuencias que esa aplicación está ya teniendo en los animales y por las que tendrá en un futuro. Esta reificación del animal –que a duras penas consigue ser limitada por los esfuerzos del animalismo– plantea el riesgo de que muchos animales terminen siendo en manos humanas una especie de juguete viviente con el que se puede hacer lo que se quiera (o casi), porque, a buen seguro, las manipulaciones serán mucho más desinhibidas y radicales que las que se hagan sobre el ser humano.
Un buen número de preocupaciones teóricas y prácticas se suscitan en cuanto comenzamos a considerar el asunto. La primera de ellas es si realmente podemos hablar de “mejoramiento” en el sentido propio del término cuando decimos que con la biotecnología estamos mejorando los animales. Esta duda es pertinente si, como se pretende, la mayor parte de estas transformaciones no van a ir dirigidas a aumentar su bienestar, sino a satisfacer intereses y deseos humanos.[13]
Pero hay otras cuestiones sobre las que merecería la pena desarrollar análisis más detallados. He aquí solo algunas de ellas: ¿Es aceptable desde un punto de vista ético y/o social cruzar las fronteras biológicas entre los seres humanos y los demás animales? ¿Qué razones fundamentadas en conocimientos biológicos pueden aducirse para considerar legítimo hacer algo así y qué razones pueden aducirse para censurarlo, y en qué casos hacer lo uno o lo otro? ¿Tendríamos la obligación moral de mejorar a los animales que experimenten padecimientos o deficiencias que hicieran más difícil su vida, como algunos sostienen (cf. Chan 2009)?
¿Y de mejorar a aquellos animales que sean “normales”, si con ello pudiéramos aumentar su bienestar o servir mejor a los intereses humanos sin perjudicarles a ellos? ¿Deberíamos corregir las deficiencias evolutivas y enmendarle la plana a la naturaleza, proporcionándole, por ejemplo, al oso panda la capacidad de tener una dieta más variada, que le permitiera vivir en hábitats diferentes y menos cerrados que el suyo propio?
¿Qué importancia habría que darle a los intereses humanos frente a los intereses de los propios animales a los que se quisiera mejorar; debería prevalecer alguno de estos intereses en caso de conflicto? ¿Deberíamos distribuir justamente entre los animales los beneficios del biomejoramiento, de modo que no hubiera individuos o especies que se vieran privilegiadas? ¿Habría que permitir la modificación radical del fenotipo de un animal, incluso a costa de que éste pudiera ser irreconocible para los miembros de su propia especie? Se ha argumentado que en tales modificaciones debe prevalecer siempre el bienestar del animal, pero ¿ese bienestar sería suficiente para justificar cualquier cambio? ¿Sería legítimo, pongamos por caso, su desmejoramiento para evitarle sufrimientos debido a su uso por los seres humanos (y por tanto para aumentar su bienestar con respecto a su situación actual)?
¿Debería permitirse la creación mediante manipulación genética de pollos ciegos que no sufran tanto estrés en las condiciones en que se encuentran en las granjas masificadas, o de cerdos con cerebros atrofiados para que no sean conscientes del sufrimiento causado por la estabulación y la matanza? ¿Deberían los organismos creados artificialmente estar protegidos por leyes en defensa de la biodiversidad, de modo que, una vez creados, tuvieran tanto derecho a no ser aniquilados como cualquier otra especie ya existente? ¿Quiénes estarían autorizados para realizar estas modificaciones en los animales y qué objetivos las guiarían? ¿Qué tipo de control público podría ejercerse sobre todo ello? Y si se considerara necesario este control, ¿cómo implementarlo? Como puede verse, hay un amplio campo aquí para la discusión filosófica, y las respuestas no son fáciles.
Quizás no sea inoportuno aclarar, llegados a este punto, que quien esto escribe considera que, al igual que sucede con el biomejoramiento humano, no hay nada intrínsecamente malo en estas tecnologías; nada por lo cual deban ser prohibidas a priori. No parece que quepa hacer demasiados reproches a la introducción de un gen de otra especie con la finalidad de hacer más resistente a una enfermedad a organismos de una especie dada, o incluso introducir en animales un gen humano para producir algún fármaco o sustancia química beneficiosa para los seres humanos (al menos mientras esto no le genere al animal una desventaja o algún tipo de sufrimiento).
Ni siquiera –aunque esto genera una mayor controversia– parece haber sólidas razones para condenar sin paliativos la inserción de células tumorales humanas en un embrión animal con objeto de estudiar mejor el modo de combatir el cáncer, teniendo en cuenta que en este caso el sufrimiento causado al animal una vez nacido es inevitable como medio para obtener una cura del cáncer que evite posteriormente mucho más sufrimiento. A mi juicio, la tan socorrida acusación de estar jugando a ser Dios no tiene ninguna fuerza de convicción para aquellos que no sean creyentes, o que (como sucede incluso con algunos teólogos) estimen que no podemos utilizar como criterio moral en una discusión filosófica lo que Dios supuestamente aprobaría.
Tampoco es muy convincente la acusación de que la aplicación de las biotecnologías de mejoramiento sería algo antinatural (unnatural) puesto que se rompen con ellas fronteras naturales que no deberían ser tocadas; y no lo es porque no está nada claro desde un punto de vista evolucionista que puedan trazarse dichas fronteras, en particular si se quiere sustentar sobre ellas juicios normativos. Desde una perspectiva evolucionista no cabe concebir a una especie como una clase natural definida por un conjunto de propiedades todas ellas individualmente necesarias y conjuntamente suficientes para ser miembro de esa clase. Una especie no viene definida por una “esencia”, y esto, por cierto, se aplica también a nuestra propia especie, lo que hace que la apelación a una naturaleza humana inviolable como sustento de nuestra condición moral se torne también sumamente problemática como argumento contra el biomejoramiento humano (cf. Diéguez 2017).
Esto no implica, sin embargo, que todo deba ser aceptado sin mayor crítica cuando estas biotecnologías estén disponibles, o en el uso que ya se hace de algunas de ellas en la modificación de los animales. Pero en la evaluación ética de este asunto (y no sólo ética, sino también política y social), antes que apelar a grandes conceptos de difícil precisión, por poderosos que estos puedan ser a la hora de tocar la sensibilidad, como el de naturaleza, dignidad, “telos”, etc., parece más útil y más productivo para la discusión –más proclive a la consecución de acuerdos–, tomar en consideración los efectos concretos previsibles que sobre el bienestar de los animales y de los seres humanos tendrá el uso de estas técnicas, por difícil que sea a veces esta previsión.
En particular si su falta de eficiencia o sus efectos adversos podrían producir en ciertas situaciones (que entonces habría que evitar) un sufrimiento injustificable, o si su aplicación está conduciendo a una instrumentalización tal de los animales que desatiende por completo su bienestar y, en no pocos casos, hasta la pervivencia de su especie. Ha habido en los últimos años una saludable sensibilización en favor de la idea de que los animales no son meros recursos a nuestra disposición, pero queda todavía un buen trecho por andar en ese camino. Un requisito indispensable para propiciar un cambio de actitud es que haya formas, a ser posible institucionalizadas, de velar por los intereses de los animales, dándoles el peso que se crea justificadamente que deban tener, -no más, pero tampoco menos-, porque de los intereses humanos ya sabemos ocuparnos.
REFERENCIAS
Anthes, E. (2013), Frankenstein’s Cat. Cuddling up to Biotech’s Brave New Beasts, London: Oneworld.
Bateman, S., J. Gayon, S. Allouche, J. Goffette y M. Marzano (eds.) (2015), Inquiring into Animal Enhancement: Model or Countermodel of Human Enhancement?, Hampshire: Palgrave Macmillan.
Bourret, R. et al. (2016), “Human-animal Chimeras: Ethical Issues about Farming Chimeric Animals Bearing Human Organs”, Stem Cell Research and Therapy, 7:87. DOI 10.1186/s13287-016-0345-9.
Burgat, F. (2015), “Improving Animals, Improving Humans: Transpositions and Comparisons”, en S. Bateman et al. (eds.), Inquiring into Animal Enhancement: Model or Countermodel of Human Enhancement?, Hampshire: Palgrave Macmillan pp.34-48.
Chan, S. (2009), “Should we Enhance Animals?”, Journal of Medical Ethics, 35, pp. 678-683.
Church, G. & E. Regis (2012), Regenesis. How Synthetic Biology Will Reinvent Nature and Ourselves, New York: Basic Books.
Crane, A.T. et al. (2019), “Concise Review: Human-Animal Neurological Chimeras: Humanized Animals or Human Cells in an Animal?”, Stem Cells, 37, pp. 444-452.
DeGrazia, D. (2002), Animal Rights. A Very Short Introduction, Oxford: Oxford University Press.
Diéguez, A. (2017), Transhumanismo. La búsqueda tecnológica del mejoramiento humano, Barcelona: Herder.
Earp, B.D., A. Sandberg, G. Kahane y J. Savulescu (2014), “When is Diminishment a Form of Enhancement? Rethinking the Enhancement Debate in Biomedical Ethics”, Frontiers in Systems Neuroscience, 8, https://dx.doi.org/10.3389/fnsys.2014.00012. Consultado el 01/08/2019.
Greely, H.T. (2011), “Human/Nonhuman Chimeras: Assessing the Issues”, en T.L. Beauchamp y R.G. Frey (eds.), The Oxford Handbook of Animal Ethics, Oxford: Oxford University Press, pp. 671-698.
Han, X. et al. (2012), “Forebrain Engraftment by Human Glial Progenitor Cells Enhances Synaptic Plasticity and Learning in Adult Mice”, Cell Steam Cell, 12 (3), pp. 342-353.
Henscke, A. (2012), “Making Sense of Animal Disenhancement”, Nanoethics, 6, pp. 55-64.
Mazlish, B. (1995), La cuarta discontinuidad. La coevolución de hombres y máquinas, Madrid: Alianza.
Montoliu, L. (2019), Editando genes: recorta, pega y colorea, Pamplona: Next Door.
Ortiz, S.E.G. (2004), “Beyond Welfare. Animal Integrity, Animal Dignity and Genetic Engineering”, Ethics and the Environment, 9(1), pp. 94-120.
Palmer, C. (2011), “Animal Disenhancement and the Non-Identity Problem: A Response to Thompson”, Nanoethics, 5, pp. 43-48.
Robert, J.S. y F. Baylis (2003), “Crossing Species Boundaries”, The American Journal of Bioethics, 3(3), pp. 1-12.
Rollin, B.E. (1995), The Frankenstein Syndrome. Ethical and Social Issues in the Genetic Engineering of Animals, Cambridge: Cambridge University Press.
——— (2012), ¿Decisiones peligrosas?: Una bioética desafiante, Madrid: Tecnos.
Sandøe, P.B., L. Nielsen, L.G. Christensen & P. Sorensen (1999), “Staying Good while Playing God. The Ethics of Breeding Farm Animals”, Animal Welfare, 8, pp. 313-328.
Streiffer, R. (2014), “Human/Non-Human Chimeras”, Stanford Encyclopedia of Philosophy, https://plato.stanford.edu/entries/chimeras/. Consultado el 01/08/2019.
Streiffer, R. y J. Basil (2011), “Ethical Issues in the Aplication of Biotechnology to Animals in Agriculture”, en T.L. Beauchamp y R.G. Frey (eds.), The Oxford Handbook of Animal Ethics, Oxford: Oxford University Press, pp. 826-854.
Thompson, P.B. (2008), “The Opposite of Human Enhancement: Nanothechnology and the Blind Chicken Problem”, Nanoethics, 2, pp. 305-316.
Windrem, M.S. et al. (2014), “A Competitive Advantage by Neonatally Engrafted Human Glial Progenitors Yields Mice Whose Brains Are Chimeric for Human Glia”, Journal of Neuroscience, 34 (48), pp. 16153-16161.
Wu, J. et al. (2016), “Stem Cells and Interspecies Chimeras”, Nature, 540, 1 de diciembre, pp. 51-59.
NOTAS
[1]Una versión previa de este primer parágrafo fue publicada por el digital El Confidencial el 3 de agosto de 2019.
[2] Conviene distinguir estas quimeras en el nivel genético, que son animales transgénicos en los que se ha insertado algún gen de otro organismo en algunas de sus células, de lo que serían las verdaderas quimeras, que son organismos en los que se han incorporado células completas de otros organismos, ya sea en su fase embrionaria o adulta. Las quimeras pueden ser a su vez interespecíficas, si las células provienen de individuos de especies distintas, o intraespecíficas, si provienen de individuos de la misma especie.
Asimismo, cabe distinguir a los híbridos transgénicos, que son organismos que contienen algún gen proveniente de organismos de otra especie en todas sus células, de los verdaderos híbridos, que son organismos surgidos de la fecundación de un gameto femenino perteneciente a una especie por un gameto masculino perteneciente a otra especie. En el caso de los híbridos animal/humano, serían organismos resultantes de la fecundación de un óvulo animal por esperma humano, o de un óvulo humano por esperma animal. También hay que distinguir de estos organismos a los híbridos citoplasmáticos, que mencionaremos a continuación.
[3] Puede consultarse la noticia dada por Asociated Press en:
https://www.nbcnews.com/id/7681252/ns/health-cloning_and_stem_cells/t/scientists-create-animals-are-part-human/#.WAdMJ8mm0w0 (consultado el 01/08/2019).
[4] Véase al respecto el artículo de la Wikipedia sobre Uplift:
https://en.wikipedia.org/wiki/Uplift_%28science_fiction%29
[5] En el verano de 2019 saltaba la noticia de que Juan Carlos Izpisúa y su equipo habían logrado crear quimeras de humano y mono en un laboratorio en China (para eludir las trabas legales en Estados Unidos y Europa), que no fueron llevadas a término.
[6] En el mismo número de The American Journal of Bioethics en el que aparece este artículo hay una serie de réplicas interesantes que discuten esta tesis. Una buena presentación del debate ético suscitado por la posibilidad de creación de quimeras e híbridos entre humanos y animales puede verse en Greely (2011) y Streiffer (2014); una discusión actualizada sobre los usos y potencialidades de las quimeras interespecíficas se encuentra en Wu et al. (2016) y en Bourret et al. (2016); y una discusión sobre las quimeras neurológicas animal-humano puede verse en Crane et al. (2019). Este último estudio llega a la conclusión de que los animales chimera a los que se les han implantado células humanas en sus tejidos nerviosos no han experimentado ninguna “humanización” significativa de su conducta y la estructura de sus cerebros ha seguido siendo la propia de su especie.
[7] Un pionero bastante desconocido de la ciencia ficción española, Jaime de Foxá, hermano del más conocido novelista Agustín de Foxá, dedicó una interesante novela a este asunto titulada Marea verde. Aquí puede leerse mi comentario sobre la misma:
https://www.diariosur.es/opinion/pionero-ciencia-ficcion-20171231005512-ntvo.html
[8] El catedrático de genética de la Universidad de Harvard ha creado ya una empresa, Rejuvenate Bio, que se anuncia con el objetivo de alargar la vida de mascotas.
[9] Puede verse la noticia en: https://www.infobae.com/2016/01/28/1785929-no-more-woof-el-primer-dispositivo-que-traduce-los-ladridos-los-perros/ (Consultado el 25/10/2016).
[10] Puede verse la noticia en: https://www.popsci.com/woolly-mammoth-dna-brought-life-elephant-cells (Consultado el 01/08/2019).
[11] Para una discusión, véase Thompson (2008), Palmer (2011) y Henscke (2012).
[12] Muy recomendable en este sentido es el libro Bateman et al. (eds.) (2015).
[13] Como bien preguntan Baterman et al. (2015, pp. 3-4), ¿[e]n qué sentido se puede decir que un animal está siendo mejorado o potenciado en lugar de simplemente modificado, manipulado, sometido a ingeniería o transformado en un producto comercializable?”.
La imagen destacada ha sido tomada de https://www.sinclairbioresources.com/support-bioproducts/behavioral-enhancement-system/
About the author

Antonio Diéguez
Es catedrático de Lógica y Filosofía de la Ciencia en la Universidad de Málaga. Fue presidente electo de la Asociación Iberoamericana de Filosofía de la Biología. Entre sus libros están La evolución del conocimiento. De la mente animal a la mente humana(Biblioteca Nueva, 2011), La vida bajo escrutinio. Una introducción a la filosofía de la biología (Biblioteca Buridán, 2012) y Transhumanismo: La búsqueda tecnológica del mejoramiento humano (Herder, 2017)


Yo hubiera titulado el artículo como «El síndrome del dr. Moreau», aunque habría que incluir esa novela (La isla del dr Moreau) de H.G. Wells entre las referencias
Sería, desde luego, otro título posible, pero que lo del Dr. Moreau está más trillado y encaja peor en la contraposición que yo quería hacer entre Frankenstein y Galatea, porque quería poner el énfasis en las criaturas y no en los creadores.
Muchas gracias por el comentario.
El autor, Antonio Diéguez, dice que:
«Sería otro título posible, pero que lo del Dr. Moreau está más trillado y encaja peor en la contraposición que quería hacer entre Frankenstein y Galatea, porque quería poner el énfasis en las criaturas, no en los creadores»